InaRIS フェロー (2021-2030)
北海道大学 低温科学研究所教授※助成決定当時
2021InaRIS生物・生命系
InaRISの10年間という長期にわたるご支援を頂けることで、現象自体が年単位で生じる冬眠の研究を、腰を据えて行い、予期せぬ実験結果も落ち着いて考える時間が取れるようになるのが嬉しいです。一緒に研究を行う研究員・技術員のサポートが得られるのも大きいです。冬眠の謎の本質に迫るべく挑戦していきます。
哺乳類の「冬眠能」の分子機構の解明を目指し、冬眠する小型哺乳類シリアンハムスターをモデル冬眠哺乳類として、個体および細胞レベルでの解析を進めた。現在までに安定した冬眠誘導系を確立し、1)個体レベルでは、冬眠の前後に生じる体温リズムの長期計測により、冬眠は単なるエネルギー節約プログラムだけでなく、来るべき春に備えた生体リズム適応プログラムを含む戦略であることを明らかにした。2)季節性のからだの変換のマーカー分子を多数同定した。3)冬眠哺乳類の細胞が示す低温耐性に必要な栄養素および遺伝子を同定した。今後、これら遺伝子の冬眠における機能をさらに追求していく。
2018年1月より北海道大学低温科学研究所で新設した研究室では、シリアンハムスター(以後、ハムスターと表記)をモデル冬眠哺乳類として、冬季環境へのしなやかな適応である哺乳類の冬眠にまつわる、「冬眠の大きな3つの謎」の分子機構解明に挑んできた。
① なぜ低温で死なないのか? 〜 冬眠動物が発揮する低温耐性の分子機構
② 夏と冬の体はどう異なる? 〜 冬眠に備えた季節性の体の変換の分子機構
③ 冬眠の際に寝起きを繰り返すのはなぜ? 〜 冬眠の発動と停止の制御機構
これらの分子機構の理解は、好奇心による探求という基礎生物学的価値を有するだけに留まらない。通常は冬眠「非耐性」状態にあるとも考えられる非冬眠動物ヒトに対しても部分的にこれら分子機構を賦与する手法の開発につなげることで、移植臓器や血液製剤の長期保存、脳梗塞・心不全の際のダメージ軽減、生活習慣病やサルコペニア予防、冬眠の名残とも言われるヒトの季節性情動障害の予防と治療など、医学・創薬へも様々な応用展開が期待される。2021年度からInaRISに採択されてからの進捗について以下に記す。
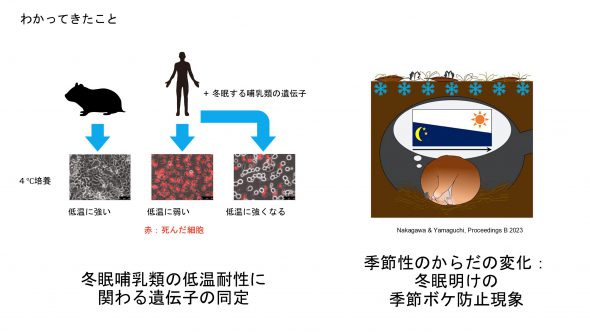
① 冬眠動物が発揮する低温耐性の分子機構: ヒトやマウスなど冬眠できない哺乳類(非冬眠哺乳類)の細胞は低温培養すると1日から数日以内には細胞死する。この非冬眠哺乳類の低温誘導性細胞死は、ある種のがん細胞が抗癌剤により鉄イオン依存的な脂質過酸化を介して死ぬ細胞死の一様式、ferroptosisに類似することが知られる。一方、ハムスターをはじめ冬眠哺乳類の細胞では、低温培養しても低温誘導性ferroptosisは生じない。この冬眠哺乳類の細胞が有する「低温耐性」について、現象自体は古くから知られていたが、そこに関わる分子や遺伝子は、全く不明な状態であった。私たちはInaRIS採択時に、ハムスターの肝細胞の低温耐性が食餌に依存することを見出していた。その後の解析の結果、ハムスターは肝臓や血中に高濃度のビタミンEを含有することで脂質過酸化を防止し、低温誘導性ferroptosisを防いでいることを明らかにし報告した(Anegawa et al., Commun Biol, 2021)。現在、なぜハムスターはなぜ高濃度のビタミンEを保持できるのか更なる解析を進めている。一方で、ハムスターの低温耐性は、ビタミンEだけでは説明できないことも見出した。ハムスター由来のがん細胞株は、培養する際にビタミンE非含有の培地でも、低温耐性を示すからである。そこで低温耐性を示すハムスターがん細胞株および低温耐性を示さないヒトがん細胞株を用いて、低温耐性の機能獲得スクリーニングと機能欠損スクリーニングを行っている。現在までに、過剰発現によりヒトがん細胞に低温耐性を賦与するものとしてGPx4遺伝子を同定(Sone et al., submitted)するとともに、機能欠損によりハムスター細胞の低温耐性を喪失させる遺伝子の候補を複数同定することに成功した(未発表)。
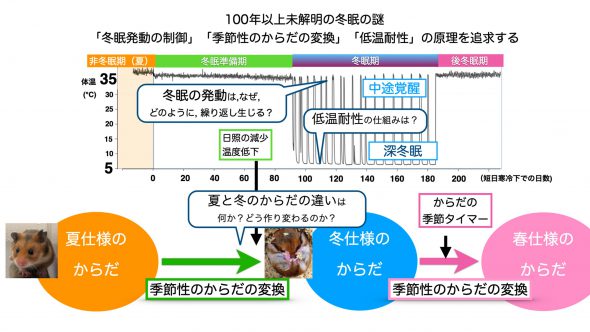
② 冬眠に備えた季節性の体の変換の分子機構:ハムスターは温暖長日条件で飼育すると体が夏仕様となるが、寒冷短日条件下に長期間置かれると、冬仕様の体へと全身をリモデリングし冬眠を行う。これまでに白色脂肪、肝臓、骨格筋、脳下垂体、心臓、褐色脂肪など、冬眠の際にその機能が重要と目される各種臓器での遺伝子発現変化プロファイルの取得に成功した。肝臓では、夏仕様と冬仕様との間で10万倍以上の発現変化を示す機能未知遺伝子群SDGs(Season-Dependent Genes)に着目し、これらの機能操作を行うアデノ随伴ウイルス系を構築し、その遺伝子機能操作で冬眠に生じる表現型を検証中である。またその他の臓器でも着目すべき遺伝子を絞り込み機能検証実験系を構築しつつある。脳下垂体と骨格筋では、冬眠期に発動が大幅に減少する多数の遺伝子の中から、全身生理や骨格筋の生理変化に関わると予想される遺伝子群に着目した解析を進めている(Shao et al., Matsuoka et al., 未発表)。一方まったく別の角度から新しい成果も得た。冬眠の際に、概日リズムや行動リズムがどう変化するのかは未だ論争の種である。私たちは近年大幅に進歩しているデータロガーを適用し1年にわたる長期間、動物の体温と活動量の取得に成功した。その解析から、長期間の冬眠の際は体温リズムが消失すること、さらに長期の冬眠期から自律的に復帰する際には、体温の概日リズム・活動リズムも夏仕様の長日型に復帰することを見出した(Nakagawa and Yamaguchi, Proc B,2023)。冬眠する動物は、日長が短くなる時期に短日型のリズムとなって巣穴の中に篭って日長シグナルのない状態で冬を乗り切るが、春先に巣穴から出てくるといきなり長くなった日長にさらされることになる。したがって、体温や活動のリズムが自律的に夏仕様の長日型に復帰することは、春先の環境適応にとって有利であると考えられる。このように冬眠は、餌の不足する冬季をエネルギー節約して乗り切るための省エネルギープログラムだけでなく、体のリズムを来るべき春に適応させておくという自律復帰プログラムも含むことが明らかになった。まさに本助成テーマの生物のしなやかさとしたたかさが垣間見える事例といえる。
③ 冬眠の発動と停止の制御機構:冬眠の際に生じる大幅な体温変動を引き起こすために必要な遺伝子・分子・神経回路についての理解は遅れている。特定の神経細胞を薬理的手法や光遺伝学などにより活性化すると冬眠に似た低体温が引き起こせることは複数報告があるが、冬眠の発動そのものに必要な遺伝子については全く報告がない。私たちは遺伝子改変ハムスターを作出することで、冬眠の発動が遅延・阻害される遺伝子の同定に成功し、その作用機序についての解析を進めている。また、冬眠哺乳類に限って冬眠が発動できるのはなぜなのか?という問いに関しては、冬眠哺乳類と非冬眠哺乳類の遺伝子比較というゲノム科学的アプローチも有用である可能性がある。この点に関しても解析を開始したところである。
Spontaneous recurrence of a summer-like diel rhythm in the body temperature of the Syrian hamster after hibernation. Nakagawa S, Yamaguchi Y*. Proceedings of the Royal Society B: Biological Sciences 290, 2009, 2023. doi.org/10.1098/rspb.2023.0922
Step-by-step protocols for non-viral derivation of transgene-free induced pluripotent stem cells from somatic fibroblasts of multiple mammalian species. Yoshimatsu S, Yamazaki A, Edamura K, Koushige Y, Shibuya H, Qian E, Sato T, Okahara J, Kishi N, Noce T, Yamaguchi Y, Okano H*. Development Growth & Differentiation 64(6):325-341, 2022. https://doi.org/10.1111/dgd.12798
Generation of transgenic mice expressing a FRET biosensor, SMART, that responds to necroptosis. Murai S, Takakura K, Sumiyama K, Moriwaki K, Terai K, Komazawa-Sakon S, Seki T, Yamaguchi Y, Mikami T, Araki K, Ohmuraya M, Matsuda M, Nakano H*. Communcations Biology 5(1):1331, 2021. https://doi.org/10.1038/s42003-022-04300-0
Hepatic resistance to cold ferroptosis in a mammalian hibernator Syrian hamster depends on effective storage of diet-derived α-tocopherol. Anegawa D, Sugiura Y, Matsuoka Y, Sone M, Shichiri M, Otsuka R, Ishida N, Yamada KI, Suematsu M, Miura M, Yamaguchi Y*. Communications Biology 4(1):796, 2021. https://doi.org/10.1038/s42003-021-02297-6
Evidence for the involvement of caspases in establishing proper cerebrospinal fluid hydrodynamics. Yoshida A, Kawata D, Shinotsuka N, Yoshida M, Yamaguchi Y*, Miura M. Neuroscience Research 170:145-153, 2021. https://doi.org/10.1016/j.neures.2020.12.006
哺乳類の冬眠は、低温・飢餓等の極限状態を全身性の代謝抑制と低体温により乗り切る生存戦略である。ヒトをはじめ多くの哺乳類は冬眠できないが、クマやリスなど一部の哺乳類は冬眠を行うことができる。これら「冬眠動物」は、ヒトなどの非冬眠動物とは異なり、長時間の低体温による傷害や、低温からの復温過程で生じうる組織損傷に対しても耐性を有する。また、冬眠に伴う長期間の不動状態で生じる筋廃用萎縮などにも、冬眠動物は耐性を有するとされる。さらに冬眠動物は、冬眠にともなう食欲・体重の季節性変動、貯蔵脂肪の効率的燃焼、季節の長さを感知する計時能力など、興味深い多くの形質を備えている。
しかし、これら冬眠に伴う一連の生理変化や形質の制御機構は、多くの技術的制約のために、未だ多くの点が不明である。こうした点を明らかにしていく冬眠研究は、生命現象に対する知識と理解を深めるだけでなく、人工冬眠や低体温下での手術など医学薬学研究への応用も大いに期待される、21世紀の生命科学に残されたフロンティアといえる。
山口氏の研究提案はこの課題に正面から取り組むものとなっている。山口氏はこれまでの10年間に、実験室での冬眠誘導が比較的容易なシリアンハムスターに近年の解析技術の進歩を導入し、冬眠実行に関わる遺伝子同定と、その個体での機能検証を目指した研究を行なってきた。現在までに、シリアンハムスターが冬眠に備えて白色脂肪組織を劇的に変化させることを明らかにした。さらに冬仕様のからだでは、脂質の異化と同化の能力を同時亢進させる何らかの内因性リガンドが生じることを示した。また食餌由来の栄養因子が低温耐性を付与することも突き止めている。冬眠時には深冬眠-中途覚醒サイクルを繰り返すが、その制御遺伝子も個体を用いた解析から同定しつつある。
このように山口氏は低体温での生存に重要な栄養因子の同定、冬眠時に大幅に発現変動する遺伝子の網羅的同定、さらに冬眠発動に重要な遺伝子の個体での機能検証に成功している。本研究は、山口氏が独自に得てきた以上の結果をもとに、冬眠の3つの大きな謎、「低温耐性」、「季節性の体の変化」、「冬眠発動」の分子機構解明を目指す壮大なものである。そして山口氏の研究提案には「しなやかさ」と「したたかさ」に満ち溢れた冬眠という未開の生命科学領域に風穴を開ける独創的な着想が濃縮されている。
山口氏は冬眠研究の新時代の旗手であり、InaRISフェローシップの支援により、今後10年という研究期間の中でこれまでにも増して次々と、斬新な発想に基づいた精緻な研究が展開され、冬眠の謎を解き明かすことが期待される。

稲盛財団は3月14日、2025年度稲盛科学研究機構(InaRIS: Inamori Research Institute for Science)のフェローを発表しました。2025年度InaRISフェローは、「数学の深化と展開」で公募を行い、29名の応募者の中から、戸田幸伸氏(東京大学国際高等研究所カブリ数物連携宇宙研究機構・教授)と平岡裕章氏(京都大学高等研究院・教授)の2名が選ばれました。

InaRISフェローシップは、好奇心の赴くまま、存分に壮大な研究に取り組むべく1人につき10年間継続・総額1億円の助成を行う研究助成プログラムです。2026年度のInaRISフェローシップについてお知らせいたします。

2024年10月17日、18日の二日間、稲盛財団(京都市下京区)において、「稲盛科学研究機構(InaRIS)フェローシップ」のアドバイザリー・ボード・ミーティング(以下、ABM)が開催されました。

2024年度InaRISフェロー紹介動画を公開しました!

2025年度の稲盛科学研究機構(InaRIS)フェローシップの申請受付を開始しました。

2024年度InaRISフェロー、星野歩子氏(左)と鈴木洋氏(右) 4月20日、京都市内のホテルで、2024年度InaRISフェロー授与式を行いました。 2024年度InaRISフェローは「異分野コンバージェンスによる⾰...

2025年度InaRISおよび稲盛研究助成の募集要項を公開しました。

公益財団法人稲盛財団(理事長 金澤しのぶ)は3月15日、2024年度稲盛科学研究機構(InaRIS: Inamori Research Institute for Science)のフェローを発表しました。2024年度I...

InaRISフェローシップは、好奇心の赴くまま、存分に壮大な研究に取り組むべく1人につき10年間継続・総額1億円の助成を行う研究助成プログラムです。2025年度のInaRISフェローシップについてお知らせいたします。 &...

プレゼンテーションを行う2023年度InaRISフェローの田中由浩氏 「稲盛科学研究機構(InaRIS)フェローシップ」の運営委員やフェロー同士が研究内容について議論を交わす「アドバイザリー・ボード・ミーティング(ABM...

2023年度InaRISフェロー紹介動画を公開しました!研究にかける熱い想いやちょっと意外な日常など、フェローの魅力をギュッと詰め込んで紹介します! 亀井 靖高 氏(九州大学大学院システム情報科学研究院准教授) 「機械と...

稲盛財団は、5月23日、2023年度の稲盛科学研究機構(InaRIS: Inamori Research Institute for Science)フェローシップの申請受付を開始しました。

4月22日、京都市内のホテルで、2023年度InaRISフェロー授与式を行いました。 2023年度InaRISフェローは「水平線の彼方の情報学」をテーマに募集し、厳正なる審査の結果、九州大学大学院システム情報科学研究院准教授の亀井靖高氏と、名古屋工業大学大学院工学研究科教授の田中由浩氏の2人が選ばれました。

InaRISフェローシップは、好奇心の赴くまま、存分に壮大な研究に取り組むべく1人につき10年間継続・総額1億円の助成を行う研究助成プログラムです。2024年度のInaRISフェローシップについてお知らせいたします。 &...

2024年度InaRISおよび稲盛研究助成の募集要項を公開しました。

公益財団法人稲盛財団(理事長 金澤しのぶ)は3月17日、2023年度稲盛科学研究機構(InaRIS:Inamori Research Institute for Science)のフェローを発表しました。2023年度In...

「稲盛科学研究機構(InaRIS)フェローシップ」の運営委員やフェロー同士が研究内容について議論を交わす「アドバイザリー・ボード・ミーティング」が10月4日、稲盛財団(京都市下京区)にて開催されました。 I...

4月23日、京都市内のホテルで、2019年InaRISフェローシップ創設以来初となる、InaRISフェロー授与式を開催しました。

本日、2023年度InaRISおよび稲盛研究助成の募集要項を公開しました。 募集要項は以下のページよりご覧いただくことができます。 InaRIS: https://www.inamori-f.or.jp/inaris 稲...

公益財団法人稲盛財団(理事長 金澤しのぶ)は3月18日、2022年度稲盛科学研究機構(InaRIS:Inamori Research Institute for Science)のフェローを発表しました。2022年度In...

InaRISフェローシップは、好奇心の赴くまま、存分に壮大な研究に取り組むべく1人につき10年間継続・総額1億円の助成を行う研究助成プログラムです。2023年度のInaRISフェローシップについてお知らせいたします。 &...

「稲盛科学研究機構(InaRIS)フェローシップ」の運営委員やフェロー同士が研究内容について議論を交わす「アドバイザリー・ボード・ミーティング」が10月3日、オンラインで開催されました。 InaRISは、短期的に成果を求...

稲盛財団は、2021年5月21日、2022年度の稲盛科学研究機構(InaRIS)フェローシップの申請受付を開始しました。今年度の募集対象分野は「物質・材料」研究の前線開拓です。

公益財団法人稲盛財団(理事長 金澤しのぶ)は3月19日、2021年度 稲盛科学研究機構(InaRIS:Inamori Research Institute for Science)のフェローを発表しました。2021年度I...

InaRISフェローシップは、好奇心の赴くまま、存分に壮大な研究に取り組むべく1人につき10年間継続・総額1億円の助成を行う研究助成プログラムです。2022年度のInaRISフェローシップについてお知らせいたします。 &...

(左から順番に・敬称略)稲盛財団理事長・金澤しのぶ、InaRIS機構長・中西重忠、InaRISフェロー・高柳匡、InaRISフェロー・野口篤史、InaRIS選考委員長・十倉好紀 挑戦的な研究にじっくり10年間トライできる...

稲盛財団の2つの研究助成である「稲盛研究助成」と「InaRIS」の2021年度の申請受付が、5月21日からはじまりました。 稲盛研究助成は、より多くのアイデアの実現可能性を検証する機会を提供して多様性と独創性のある研究を...

公益財団法人稲盛財団(理事長 金澤しのぶ)は本日、2020年度稲盛科学研究機構(InaRIS:Inamori Research Institute for Science)のフェローを決定しました。本プログラム初となる2...

InaRISフェローシップは、好奇心の赴くまま、存分に壮大な研究に取り組むべく1人につき10年間継続・総額1億円の助成を行う研究助成プログラムです。 本年の公募に先立ちまして、プログラム内容や申請資格等について、東京・京...

InaRISフェローシップは、好奇心の赴くまま、存分に壮大な研究に取り組むべく、1人につき10年間継続・総額1億円の助成を行う研究助成プログラムです。2021年度のInaRISフェローシップでは、下記のキーワードに関わる...

国内の自然科学、人文・社会科学の若手研究者を対象に、多彩な研究活動を助成することによって、それぞれの研究者の可能性を開花させ、さらに大きな課題に取り組む契機を創出することを目的としています。

InaRIS(稲盛科学研究機構フェローシッププログラム)および2020年度稲盛研究助成に関する募集要項を公開しました。

稲盛財団は本日、文部科学省(東京都千代田区)において記者会見をおこない、新たな助成プログラム「稲盛科学研究機構(InaRIS※)フェローシップ」の創設を発表しました。
生物・生命系領域