InaRIS フェロー (2021-2030)
東京大学 先端科学技術研究センター教授※助成決定当時
2021InaRIS生物・生命系
昨年、研究室を立ち上げたのですが、研究よりも資金繰りに頭を悩ませる日々が続いておりました。この度InaRISに10年という長期間にわたり支援していただけることになり、感謝(と少しの安堵)の気持ちでいっぱいです。わたしの研究者人生も折返し地点となりました。残りの研究者人生、好奇心の赴くままにタンパク質や核酸のはたらく仕組みを研究していきたいと考えております。
新規のCas酵素Cas12c2、Cas12f、Cas13bt3のクライオ電子顕微鏡構造を決定し、それらの作動機構を解明した。2020年、東京大学おいて研究室を立ち上げ、最新のCas酵素Cas7-11-Csx29やCas9の祖先タンパク質IscBの立体構造を世界にさきがけて解明した。さらに、Cas酵素に加え、DNA組換え酵素(リコンビナーゼ)の研究にも着手し、Bxb1リコンビナーゼ-DNA複合体、および、前例のないRNA依存性リコンビナーゼIS110の立体構造を決定し、多様なDNA組換えメカニズムを解明、ゲノム編集技術の開発基盤を確立した。
原核生物のもつCRISPR-Cas獲得免疫機構では、多様なCas酵素がウイルスなどの外来核酸に対する防御を担っている。Cas酵素はガイドRNAと複合体を形成し、ガイドRNAと相補的な核酸(DNAまたはRNA)を認識・切断する。これまでにクライオ電子顕微鏡を用い、新規のCas酵素であるCas12c2(Kurihara et al., Mol Cell 2022)、Cas12f(Takeda et al., Mol Cell 2021)、Cas13bt3(Nakagawa et al., Mol Cell 2022)などの立体構造を決定し、これらの作動メカニズムを解明した。2020年、東京大学先端科学技術研究センターにおいて研究室を立ち上げ、新規のCas酵素であるCas7-11-Csx29やCas9の祖先タンパク質IscBの構造機能研究を推進した(Kato et al., Cell 2022; Kato et al. Science 2022; Kato et al., Nat Commun 2022)。さらに、DNA組換え酵素(リコンビナーゼ)の研究に着手し、Bxb1セリンリコンビナーゼ、さらに、新規のRNA依存性リコンビナーゼIS110の構造機能研究を推進している。
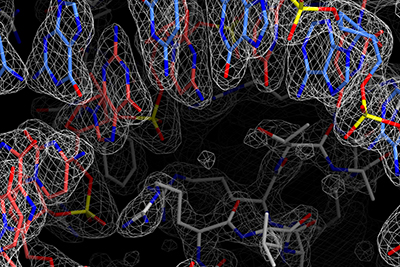
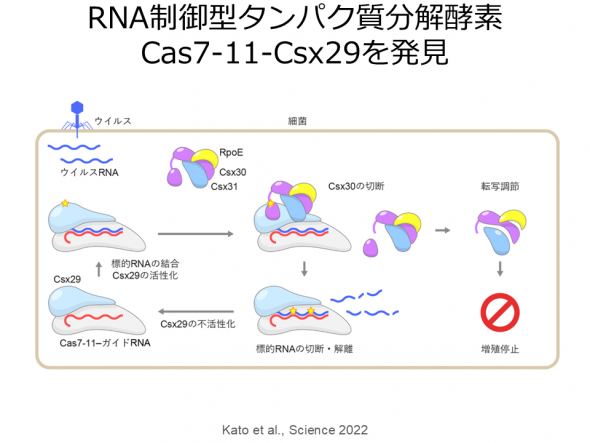
III-E型CRISPR-Cas獲得免疫機構に関与するCas7-11タンパク質は4つのCas7ドメインと1つのCas11ドメインからなり、ガイドRNAと相補的な1本鎖RNAを配列特異的に2か所で切断する新規のRNA依存性RNA切断酵素である。Cas7-11は特異性が高く、細胞毒性の低いRNA切断ツールとして期待されているが、Cas7-11の立体構造は不明であるため、その作動機構は謎に包まれていた。また、III-E型CRISPR-Cas領域には、Cas7-11に加えて、Csx29、Csx30、Csx31、RpoEといった機能未知タンパク質がコードされていることから、これら5種類のタンパク質が協働して抗ウイルス防御を担っていると考えられているが、その分子機構は不明だった。そこで、Cas7-11-ガイドRNA-標的RNA複合体のクライオ電子顕微鏡構造を決定し、Cas7-11がガイドRNAと協働し標的RNAを特異的に切断する分子機構を世界にさきがけて報告した(Kato et al., Cell 2022)。構造解析の結果、Cas7-11は4つのCas7ドメイン(Cas7.1-Cas7.4)、Cas11ドメイン、INSドメイン、CTEドメインが4つのリンカー領域で連結したユニークな立体構造をもつことが明らかになった。in vitroにおけるRNA切断実験の結果、Cas7-11は標的RNAの塩基3-4間、塩基9-10間のホスホジエステル結合を切断することが明らかになった。以上の結果から、Cas7-11によるRNA依存性RNA切断の分子機構が明らかになった。さらに、得られた立体構造の情報を基に、小型で標的組織への効率的な送達が可能なノックダウンツールCas7-11改変体(Cas7-11S)を開発した(Kato et al., Cell 2022)。
つぎに、生化学的解析から、Cas7-11-ガイドRNA-Csx29複合体に標的RNAが結合するとCsx29によってCsx30タンパク質が2つの断片に切断されることを明らかにした(Kato et al., Science 2022)。さらに、Cas7-11-ガイドRNA-Csx29複合体およびCas7-11-ガイドRNA-Csx29-標的RNA複合体のクライオ電子顕微鏡解析を決定し、標的RNAが結合するとCsx29の活性部位の立体構造が変化しCsx30と結合できるようになることを明らかにした。これらの結果から、Cas7-11-Csx29複合体は標的RNA切断活性およびCsx30切断活性という2つの酵素活性をもつ、前例のないRNA依存性ヌクレアーゼ-プロテアーゼ複合体であることが明らかになった。また、Csx30を大腸菌において過剰発現させると菌体の増殖が阻害されること、および、Csx30、Csx31、RpoEは複合体を形成することを明らかにした。これらの結果から、III-E型CRISPR-Cas獲得免疫機構において、Cas7-11-Csx29複合体はウイルス由来RNAを切断するとともに、Csx30を切断しRpoEによる転写制御を介して感染細胞の増殖を停止させることにより、細胞集団をウイルス感染から守るという新規の抗ウイルス防御機構を提唱した(Kato et al., Science 2022)。
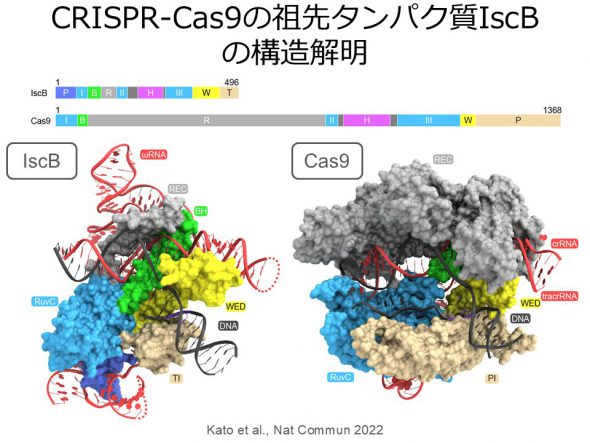
ゲノム編集に広く利用されているRNA依存性DNA切断酵素Cas9は、トランスポゾンにコードされるIscBとよばれる小型タンパク質から進化したと考えられているが、分子進化の詳細は不明だった。そこで、IscB-ガイドRNA-標的DNA複合体のクライオ電子顕微鏡構造を決定した。IscBとCas9の構造比較から、IscBにタンパク質ドメインが付加しガイドRNAが小型化することにより、CRISPR-Cas9へと分子進化したことが示唆された(Kato et al., Nat Commun 2022)。
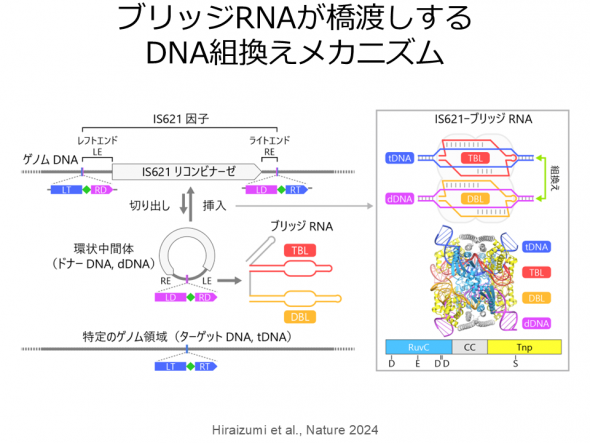
リコンビナーゼは自然界に最も多く存在するタンパク質であり、転位酵素(トランスポザーゼ)と組込み酵素(インテグラーゼ)に分類され、ウイルスから高等真核生物にいたる生物種において多様な機能を担っている。ファージ由来セリンリコンビナーゼBxb1は、特定の塩基配列(attPとattB)をもつドナーDNAとターゲットDNAの間の組換え反応を触媒するため、ゲノム編集技術にも応用されている。セリンインテグラーゼは1980年代から研究されており、分子の回転を伴うDNA組換えメカニズムが提唱されているが、その詳細は不明だった。そこで、クライオ電子顕微鏡を用いて、Bxb1-DNA複合体の立体構造を決定し、回転を伴うDNA組換えメカニズムの可視化に成功した。 さらに、既知のリコンビナーゼと異なる、新規のRNA依存性リコンビナーゼIS621リコンビナーゼを同定した。IS621はIS110ファミリーに分類される。機能解析の結果、IS621リコンビナーゼはブリッジRNAと複合体を形成し、ブリッジRNAのガイド配列と相補的な配列をもつドナーDNAおよびターゲットDNAの間の組換え反応を触媒することが明らかになった。さらに、クライオ電子顕微鏡を用いて、IS621リコンビナーゼ-ブリッジRNA-ドナーDNA-ターゲットDNA複合体の立体構造を決定し、そのRNA依存性DNA組換えの分子機構を解明した。IS110はCas9と異なる新規の革新的ゲノム編集ツールとして利用されると期待されており、その立体構造情報はゲノム編集技術の開発基盤となると考えられる。 
CRISPR-Casは、細菌の獲得免疫を担う「したたかな」システムである。細菌がウイルス感染にさらされると、ウイルスの配列の一部が、細菌ゲノム中のCRISPR領域に取り込まれ、同じウイルスが再侵入した際、CRISPR上に記憶されたウイルスの配列を用いて、Cas酵素が侵入者のゲノムを切断するというものである。Cas酵素の一つであるCas9はRNA依存性DNA切断酵素であり、任意のRNA配列を鋳型(ガイドRNA)として用いて標的DNA配列をピンポイントで切断する。このCRISPR-Cas9を用いた「ゲノム編集」は、「生命の設計図」であるゲノム情報を自在に改変できる画期的技術として、分子生物学的な基礎研究から、創薬、遺伝子治療、農作物の品種改良など幅広い利用が進んでいる。去年のノーベル化学賞受賞テーマであることも記憶に新しい。
西増氏は、これまで、構造生物学の視点でCRISPR-Casシステムの構造・作用の理解と応用へ顕著な成果を挙げてきた。例えば、ゲノム編集に汎用されている化膿レンサ球菌Cas9‐ガイドRNA‐標的DNA複合体の結晶構造を世界に先駆けて決定した。さらには、その構造をベースにCas9の立体構造を改変し、ゲノム編集技術の適用範囲を従来の4倍に拡張した。また、一分子観測の専門家との共同研究から、Cas9がDNAを切断する過程の動画撮影にも成功している。
しかしながら、Cas酵素は多様であり、Cas9以外にも多くの異なるタイプが存在する。だが多くのCas酵素の機能はよく解っていない。西増氏は、ごく最近、クライオ電子顕微鏡を用いて、知られる限り最も小さなCas酵素であるCas12fのガイドRNA-標的DNA複合体の構造を決定し、その全く新たな動作原理を明らかにしている。
西増氏の研究提案は、本人の強みであるタンパク質‐RNA複合体の構造解析と酵素学的アプローチによって、これら機能不明なCas酵素群の動作原理の解明に取り組むものである。さらには、海洋メタゲノミクスの専門家とタッグを組むことにより、深海など極限状態にて「しなやかに」かつ「したたかに」生育する微生物から、全く新しいタイプのCas酵素を探索し、その構造と機能の解明を目指す。たとえば、好熱性細菌由来のTaqポリメラーゼが、ポリメラーゼ連鎖反応(PCR)の汎用化と医学生物学の研究や診断にイノベーションをもたらしたように、高温・高圧など極限環境に適応・生育する微生物は、新たな酵素探索のフロンティアである。
西増氏は、2020年夏に独立したての新進気鋭の構造生物学者である。そのため、InaRISフェローシップの支援により、今後10年という研究期間の中で、大胆で自在な発想の下、Cas酵素研究の進展とゲノム編集ツールの発展が期待される。さらには、Cas酵素にとどまらない、全く未知な有用タンパク質‐RNA複合体酵素の発見につながり、その構造と動作の仕組みの解明を通じて生物学の新たな発展に貢献していくことが期待される。

稲盛財団は3月14日、2025年度稲盛科学研究機構(InaRIS: Inamori Research Institute for Science)のフェローを発表しました。2025年度InaRISフェローは、「数学の深化と展開」で公募を行い、29名の応募者の中から、戸田幸伸氏(東京大学国際高等研究所カブリ数物連携宇宙研究機構・教授)と平岡裕章氏(京都大学高等研究院・教授)の2名が選ばれました。

InaRISフェローシップは、好奇心の赴くまま、存分に壮大な研究に取り組むべく1人につき10年間継続・総額1億円の助成を行う研究助成プログラムです。2026年度のInaRISフェローシップについてお知らせいたします。

2024年10月17日、18日の二日間、稲盛財団(京都市下京区)において、「稲盛科学研究機構(InaRIS)フェローシップ」のアドバイザリー・ボード・ミーティング(以下、ABM)が開催されました。

2024年度InaRISフェロー紹介動画を公開しました!

2025年度の稲盛科学研究機構(InaRIS)フェローシップの申請受付を開始しました。

2024年度InaRISフェロー、星野歩子氏(左)と鈴木洋氏(右) 4月20日、京都市内のホテルで、2024年度InaRISフェロー授与式を行いました。 2024年度InaRISフェローは「異分野コンバージェンスによる⾰...

2025年度InaRISおよび稲盛研究助成の募集要項を公開しました。

公益財団法人稲盛財団(理事長 金澤しのぶ)は3月15日、2024年度稲盛科学研究機構(InaRIS: Inamori Research Institute for Science)のフェローを発表しました。2024年度I...

InaRISフェローシップは、好奇心の赴くまま、存分に壮大な研究に取り組むべく1人につき10年間継続・総額1億円の助成を行う研究助成プログラムです。2025年度のInaRISフェローシップについてお知らせいたします。 &...

プレゼンテーションを行う2023年度InaRISフェローの田中由浩氏 「稲盛科学研究機構(InaRIS)フェローシップ」の運営委員やフェロー同士が研究内容について議論を交わす「アドバイザリー・ボード・ミーティング(ABM...

2023年度InaRISフェロー紹介動画を公開しました!研究にかける熱い想いやちょっと意外な日常など、フェローの魅力をギュッと詰め込んで紹介します! 亀井 靖高 氏(九州大学大学院システム情報科学研究院准教授) 「機械と...

稲盛財団は、5月23日、2023年度の稲盛科学研究機構(InaRIS: Inamori Research Institute for Science)フェローシップの申請受付を開始しました。

4月22日、京都市内のホテルで、2023年度InaRISフェロー授与式を行いました。 2023年度InaRISフェローは「水平線の彼方の情報学」をテーマに募集し、厳正なる審査の結果、九州大学大学院システム情報科学研究院准教授の亀井靖高氏と、名古屋工業大学大学院工学研究科教授の田中由浩氏の2人が選ばれました。

InaRISフェローシップは、好奇心の赴くまま、存分に壮大な研究に取り組むべく1人につき10年間継続・総額1億円の助成を行う研究助成プログラムです。2024年度のInaRISフェローシップについてお知らせいたします。 &...

2024年度InaRISおよび稲盛研究助成の募集要項を公開しました。

公益財団法人稲盛財団(理事長 金澤しのぶ)は3月17日、2023年度稲盛科学研究機構(InaRIS:Inamori Research Institute for Science)のフェローを発表しました。2023年度In...

「稲盛科学研究機構(InaRIS)フェローシップ」の運営委員やフェロー同士が研究内容について議論を交わす「アドバイザリー・ボード・ミーティング」が10月4日、稲盛財団(京都市下京区)にて開催されました。 I...

4月23日、京都市内のホテルで、2019年InaRISフェローシップ創設以来初となる、InaRISフェロー授与式を開催しました。

本日、2023年度InaRISおよび稲盛研究助成の募集要項を公開しました。 募集要項は以下のページよりご覧いただくことができます。 InaRIS: https://www.inamori-f.or.jp/inaris 稲...

公益財団法人稲盛財団(理事長 金澤しのぶ)は3月18日、2022年度稲盛科学研究機構(InaRIS:Inamori Research Institute for Science)のフェローを発表しました。2022年度In...

InaRISフェローシップは、好奇心の赴くまま、存分に壮大な研究に取り組むべく1人につき10年間継続・総額1億円の助成を行う研究助成プログラムです。2023年度のInaRISフェローシップについてお知らせいたします。 &...

「稲盛科学研究機構(InaRIS)フェローシップ」の運営委員やフェロー同士が研究内容について議論を交わす「アドバイザリー・ボード・ミーティング」が10月3日、オンラインで開催されました。 InaRISは、短期的に成果を求...

稲盛財団は、2021年5月21日、2022年度の稲盛科学研究機構(InaRIS)フェローシップの申請受付を開始しました。今年度の募集対象分野は「物質・材料」研究の前線開拓です。

公益財団法人稲盛財団(理事長 金澤しのぶ)は3月19日、2021年度 稲盛科学研究機構(InaRIS:Inamori Research Institute for Science)のフェローを発表しました。2021年度I...

InaRISフェローシップは、好奇心の赴くまま、存分に壮大な研究に取り組むべく1人につき10年間継続・総額1億円の助成を行う研究助成プログラムです。2022年度のInaRISフェローシップについてお知らせいたします。 &...

(左から順番に・敬称略)稲盛財団理事長・金澤しのぶ、InaRIS機構長・中西重忠、InaRISフェロー・高柳匡、InaRISフェロー・野口篤史、InaRIS選考委員長・十倉好紀 挑戦的な研究にじっくり10年間トライできる...

稲盛財団の2つの研究助成である「稲盛研究助成」と「InaRIS」の2021年度の申請受付が、5月21日からはじまりました。 稲盛研究助成は、より多くのアイデアの実現可能性を検証する機会を提供して多様性と独創性のある研究を...

公益財団法人稲盛財団(理事長 金澤しのぶ)は本日、2020年度稲盛科学研究機構(InaRIS:Inamori Research Institute for Science)のフェローを決定しました。本プログラム初となる2...

InaRISフェローシップは、好奇心の赴くまま、存分に壮大な研究に取り組むべく1人につき10年間継続・総額1億円の助成を行う研究助成プログラムです。 本年の公募に先立ちまして、プログラム内容や申請資格等について、東京・京...

InaRISフェローシップは、好奇心の赴くまま、存分に壮大な研究に取り組むべく、1人につき10年間継続・総額1億円の助成を行う研究助成プログラムです。2021年度のInaRISフェローシップでは、下記のキーワードに関わる...

国内の自然科学、人文・社会科学の若手研究者を対象に、多彩な研究活動を助成することによって、それぞれの研究者の可能性を開花させ、さらに大きな課題に取り組む契機を創出することを目的としています。

InaRIS(稲盛科学研究機構フェローシッププログラム)および2020年度稲盛研究助成に関する募集要項を公開しました。

稲盛財団は本日、文部科学省(東京都千代田区)において記者会見をおこない、新たな助成プログラム「稲盛科学研究機構(InaRIS※)フェローシップ」の創設を発表しました。
生物・生命系領域